Często pojawia się problem z określeniem, która elektroda jest katodą, a która anodą. Dobrym początkiem jest zdefiniowanie pojęć.
Spis treści
Pojęcie katody i anody - proste wyjaśnienie
W substancjach złożonych elektrony pomiędzy atomami w związkach nie są rozmieszczone równomiernie. Oddziaływanie to powoduje, że cząsteczki przemieszczają się z atomu jednej substancji do atomu innej. Reakcja ta nazywana jest reakcją utleniania-redukcji. Utrata elektronów nazywana jest utlenianiem, a pierwiastek, który oddaje elektrony, nazywany jest reduktorem.
Dodawanie elektronów nazywa się redukcją, a pierwiastek przyjmujący elektrony - utleniaczem. Przenoszenie elektronów z czynnika redukującego do utleniającego może odbywać się poprzez obwód zewnętrzny, a następnie może być wykorzystane jako źródło energii elektrycznej. Urządzenia, które przekształcają energię reakcji chemicznej w energię elektryczną, nazywane są ogniwami galwanicznymi.
Najprostszym klasycznym przykładem ogniwa galwanicznego są dwie płytki wykonane z różnych metali i zanurzone w roztworze elektrolitu. W tym systemie na jednym metalu zachodzi utlenianie, a na drugim redukcja.
WAŻNE! Elektroda, na której zachodzi proces utleniania, nazywana jest anodą. Elektroda, na której zachodzi redukcja, nazywana jest katodą.
Znanym przykładem ze szkolnych podręczników chemii jest ogniwo galwaniczne miedziowo-cynkowe, którego działanie polega na absorbowaniu energii reakcji między cynkiem a siarczanem miedzi. W urządzeniu Jacoby'ego-Daniela płytka miedziana jest umieszczona w roztworze siarczanu miedzi (elektroda miedziana), a płytka cynkowa jest zanurzona w roztworze siarczanu cynku (elektroda cynkowa). Elektroda cynkowa oddaje do roztworu kationy, tworząc w nim nadmiar ładunku dodatniego, natomiast przy elektrodzie miedzianej roztwór jest pozbawiony kationów, a więc jest naładowany ujemnie.
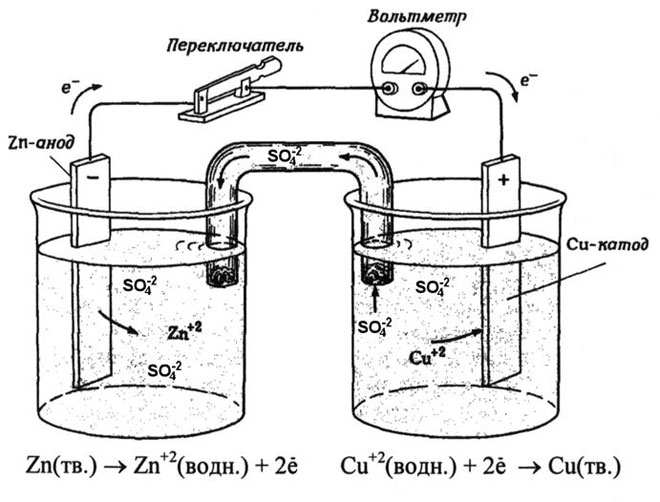
Zamknięcie obwodu zewnętrznego powoduje przepływ elektronów z elektrody cynkowej do elektrody miedzianej. Stosunki równowagi na granicach faz są zakłócone. Następuje reakcja redoks.
Energia spontanicznej reakcji chemicznej jest przekształcana w energię elektryczną.
Jeśli reakcja chemiczna jest wywołana przez zewnętrzną energię elektryczną, zachodzi proces zwany elektrolizą. Procesy zachodzące podczas elektrolizy są odwrotnością procesów zachodzących podczas działania ogniwa galwanicznego.
UWAGA! Elektroda, na której zachodzi redukcja, jest również nazywana katodą, ale w elektrolizie jest ona naładowana ujemnie, a anoda dodatnio.
Zastosowania elektrochemiczne
Anody i katody biorą udział w wielu reakcjach chemicznych:
- Elektroliza;
- Elektroekstrakcja;
- Powłoki galwaniczne;
- Powłoki galwaniczne.
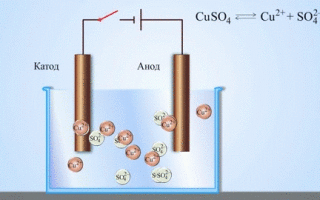
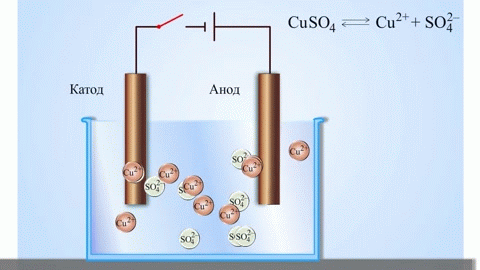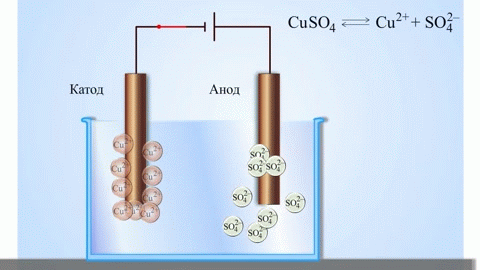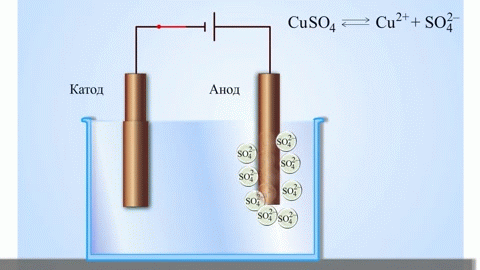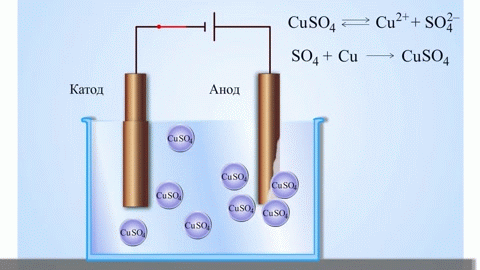
W wyniku elektrolizy stopionych związków i roztworów wodnych otrzymuje się metale, oczyszcza się je z zanieczyszczeń i wyodrębnia cenne składniki (rafinacja elektrolityczna). Płyty są odlewane z metalu, który ma być poddany rafinacji. Płyty są umieszczane w elektrolizerze jako anody. Metal jest rozpuszczany pod wpływem prądu elektrycznego. Jego kationy przechodzą do roztworu i są wyładowywane na katodzie, tworząc osad czystego metalu. Zanieczyszczenia zawarte w pierwotnej surowej płytce metalowej albo pozostają nierozpuszczalne w postaci osadu anodowego, albo przechodzą do elektrolitu, gdzie są usuwane. Miedź, nikiel, ołów, złoto, srebro i cyna są poddawane rafinacji elektrolitycznej.
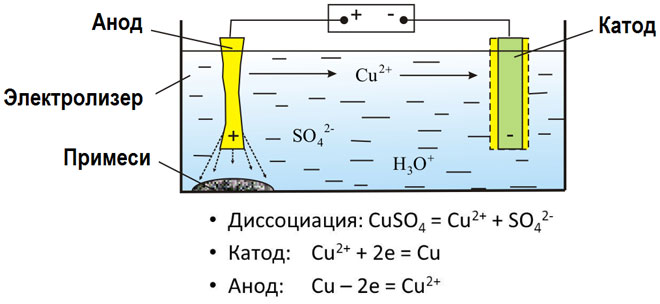
Elektroekstrakcja to proces ekstrakcji metalu z roztworu w procesie elektrolizy. Aby przenieść metal do roztworu, poddaje się go działaniu specjalnych odczynników. W procesie tym na katodzie wyodrębnia się metal o wysokiej czystości. W ten sposób wytwarza się cynk, miedź i kadm.
Aby uniknąć korozji, wzmocnić produkt i nadać mu bardziej dekoracyjny wygląd, powierzchnia jednego metalu jest pokrywana drugim. Proces ten nazywany jest galwanizacją.

Elektroformowanie to proces wytwarzania metalowych kopii obiektów trójwymiarowych metodą elektroosadzania metalu.

Zastosowania elektroniki próżniowej
Zasadę działania katody i anody w urządzeniu próżniowym można zademonstrować na przykładzie lampy elektronowej. Wygląda to jak hermetycznie zamknięte naczynie z metalowymi częściami w środku. Urządzenie służy do prostowania, generowania i przekształcania sygnałów elektrycznych. Rozróżnia się je w zależności od liczby elektrod:
- diody;
- triody;
- tetrody;
- pentody itp.
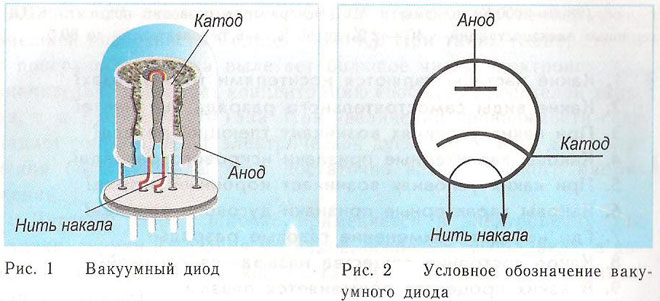
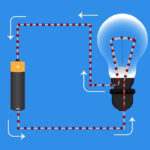
Dioda to urządzenie próżniowe z dwiema elektrodami, katodą i anodą. Katoda jest podłączona do ujemnego bieguna zasilacza, a anoda do bieguna dodatniego. Zadaniem katody jest emitowanie elektronów po podgrzaniu jej przez prąd elektryczny do określonej temperatury. Elektrony są wykorzystywane do wytworzenia ładunku przestrzennego pomiędzy katodą a anodą. Najszybsze elektrony pędzą w kierunku anody, mijając ujemną barierę potencjału ładunku przestrzennego. Anoda odbiera cząsteczki. W obwodzie zewnętrznym powstaje prąd anodowy. Przepływ elektronów jest kontrolowany za pomocą dodatkowych elektrod, do których doprowadza się potencjał elektryczny. Diody służą do przekształcania prądu zmiennego w prąd stały.
Zastosowania w elektronice
Obecnie stosowane są diody półprzewodnikowe.
Właściwość diod polegająca na przepuszczaniu prądu w kierunku zgodnym z ruchem wskazówek zegara i nieprzekazywaniu prądu w kierunku przeciwnym jest szeroko wykorzystywana w elektronice.
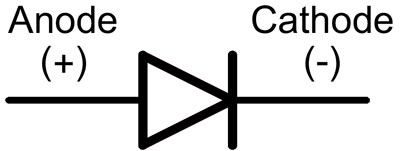
Działanie diody LED opiera się na właściwości kryształów półprzewodnikowych polegającej na świeceniu, gdy przez złącze p-n przepływa prąd w kierunku do przodu.
Galwaniczne źródła prądu stałego - baterie
Chemiczne źródła prądu elektrycznego, w których zachodzą reakcje odwracalne, nazywane są akumulatorami: można je ładować i używać wielokrotnie.

Gdy akumulator kwasowo-ołowiowy działa, zachodzi reakcja redoks. Metaliczny ołów jest utleniany i oddaje swoje elektrony, redukując dwutlenek ołowiu, który przejmuje elektrony. Metaliczny ołów w akumulatorze jest anodą i jest naładowany ujemnie. Dwutlenek ołowiu stanowi katodę i jest naładowany dodatnio.
W trakcie rozładowywania akumulatora zużywane są substancje zawarte w katodzie i anodzie oraz ich elektrolit - kwas siarkowy. Aby naładować akumulator, należy go podłączyć do źródła prądu (plus do plusa, minus do minusa). Kierunek prądu jest teraz przeciwny do tego, który był w momencie rozładowywania akumulatora. Procesy elektrochemiczne zachodzące na elektrodach są "odwrócone". Elektroda ołowiowa staje się teraz katodą, w której zachodzi proces redukcji, a dwutlenek ołowiu - anodą, w której zachodzi proces utleniania. Substancje niezbędne dla akumulatora są ponownie wytwarzane w akumulatorze.
Skąd bierze się to zamieszanie?
Problem pojawia się, ponieważ dany znak ładunku nie może być trwale związany ani z anodą, ani z katodą. Często katoda jest elektrodą naładowaną dodatnio, a anoda ujemnie. Często, ale nie zawsze. Wszystko zależy od procesu zachodzącego na elektrodzie.
OSTRZEŻENIE! Część, która została umieszczona w elektrolicie, może być zarówno anodą, jak i katodą. Wszystko zależy od celu procesu: nałożenie kolejnej warstwy metalu lub usunięcie warstwy metalu.
Jak rozpoznać anodę i katodę
W elektrochemii anoda jest elektrodą, na której zachodzą procesy utleniania, a katoda jest elektrodą, na której zachodzi redukcja.
W diodzie przewody nazywane są anodą i katodą. Prąd będzie płynął przez diodę, jeśli jej przewód anodowy będzie podłączony do plusa, a przewód katodowy do minusa.
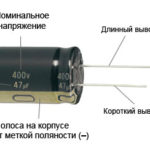
W przypadku nowej diody LED z nieobciętymi stykami, anoda i katoda są określane wizualnie na podstawie długości. Katoda jest krótsza.

Jeśli styki są przecięte, pomocna będzie bateria podłączona do nich. Światło pojawi się, gdy polaryzacje będą zgodne.
Znak anody i katody
W elektrochemii bardziej poprawne jest mówienie o procesach zachodzących na elektrodach, a nie o znakach elektrod. Reakcja redukcji zachodzi na katodzie, a reakcja utleniania na anodzie.
W elektrotechnice katoda jest połączona z biegunem ujemnym źródła prądu, a anoda z biegunem dodatnim.
Powiązane artykuły: